動く細胞の形
動く真核細胞の運動性にまつわる機能は多岐にわたります。私達の体内では、リンバ球、マクロファージ、好中球はアメーバ様の固有の形をそれぞれ状況に応じてとります。異物の追跡と取り込みや、生体内の老廃物の除去、抗原提示など、細胞の動きと変形はなくてはならない性質です。また、内皮細胞は血管のネットワーク、神経細胞は神経ネットワーク形成に適した形状をとることで知られます。こうした細胞種を一堂に並べて、細胞園として展示できたなら、動物園に負けるとも劣らない多様性と生物の巧みさに感嘆するでしょう。仮足の長さや、出したり引っ込めたりする頻度、角度は細胞の探索性を左右しますし、どのような地形、足場で移動しやすいか、標的となる分子や細胞を捕獲できるかに関わってきます。またカップ状の細胞膜の慎重は食作用や飲作用といった栄養の取り込みに必須で、この形状、動態もどのような物体をつかめるのか、取り込めるか、あるいは押して移動させるのか等を大きく左右します。このように動く細胞が分化することは、機能に即した細胞膜の形状変化を介した細胞の働き、分業にあると言ってもよいほどです。それが私達の体のように同一の細胞から出現しうることに驚きを禁じえません。多くの先天性の疾患や、癌細胞の浸潤、組織の老化の背景には、細胞が本来とるべき運動をとれなくなくなる、またはとるべきではない運動形態をもつことと密接に関わっていることから、動く細胞の形と運動の基礎的な理解が進むことは基礎から応用まで広い重要性をもっています。
細胞のある機能が、細胞外のシグナル因子と細胞膜上の受容体との特異性の高い相互作用によっていかに実現されるかは、遺伝学的、生化学的、薬学的な課題である一方で、細胞変形や運動そのものは、細胞生物学、生物物理学的かつ細胞のシステムとしての特性とのしての理解が重要です。動くロボットにどのようなネジやモーターやベアリングをつかうかはもちろん重要ですが、それをどのように制御するかというソフトの問題があります。細胞にはハードとソフトの明確な境目がありませんが、遺伝子のコドンや、オペロンによるフィードバック制御、ファージのスイッチ、細胞周期や概日周期などの繰り返し生じる現象など、細胞の生物学はハードのみならずソフト面を明らかにしてきた歴史でもあります。こうした先例では、オン・オフといった比較的単純な出力が対象とするものが多く、そのロジックも発現制御の分子機構レベルに帰着できます。一方で、細胞運動は出力が連続的、かつ時間と空間とともに変化し、いわば航空機のオートパイロットのようなものと言ってもいいかもしれません。航空機と違うのは、柔らかく可塑的な細胞膜が変形するというの制御ロジックはどのようなものなのでしょうか。
細胞の変形動態の理解は私達のこうした形態の背景にはもちろん種や細胞型に固有の特殊性が多くありますが、一方で真核細胞が共通して有する分子キットを用いて実現しやすい運動形態には、内因的な典型があると思われます。アクチンフィラメントが形成されることによって生じる伸長力と、ミオシンによって架橋されたアクチンフィラメントによる収縮力に大きくよります。これらが細胞内で空間的に、時間的にどのように分布するかが、細胞形状を大きく決定すると考えられています。細胞性粘菌、好中球などの単独遊走性能の高い細胞型は、そのアメーバ的な不定形を特徴としていて、自由自在に仮足をだす方向を変えていくことで高い探索性を有することと、前と後ろを単一のペアとして維持する細胞極性を強めることで、指向性を高めるという相反する性質を有しています。こうした動く細胞の形とそのダイナミクスを定量的に特徴づけ、数理的な表現を含めた探求をおこなっています。
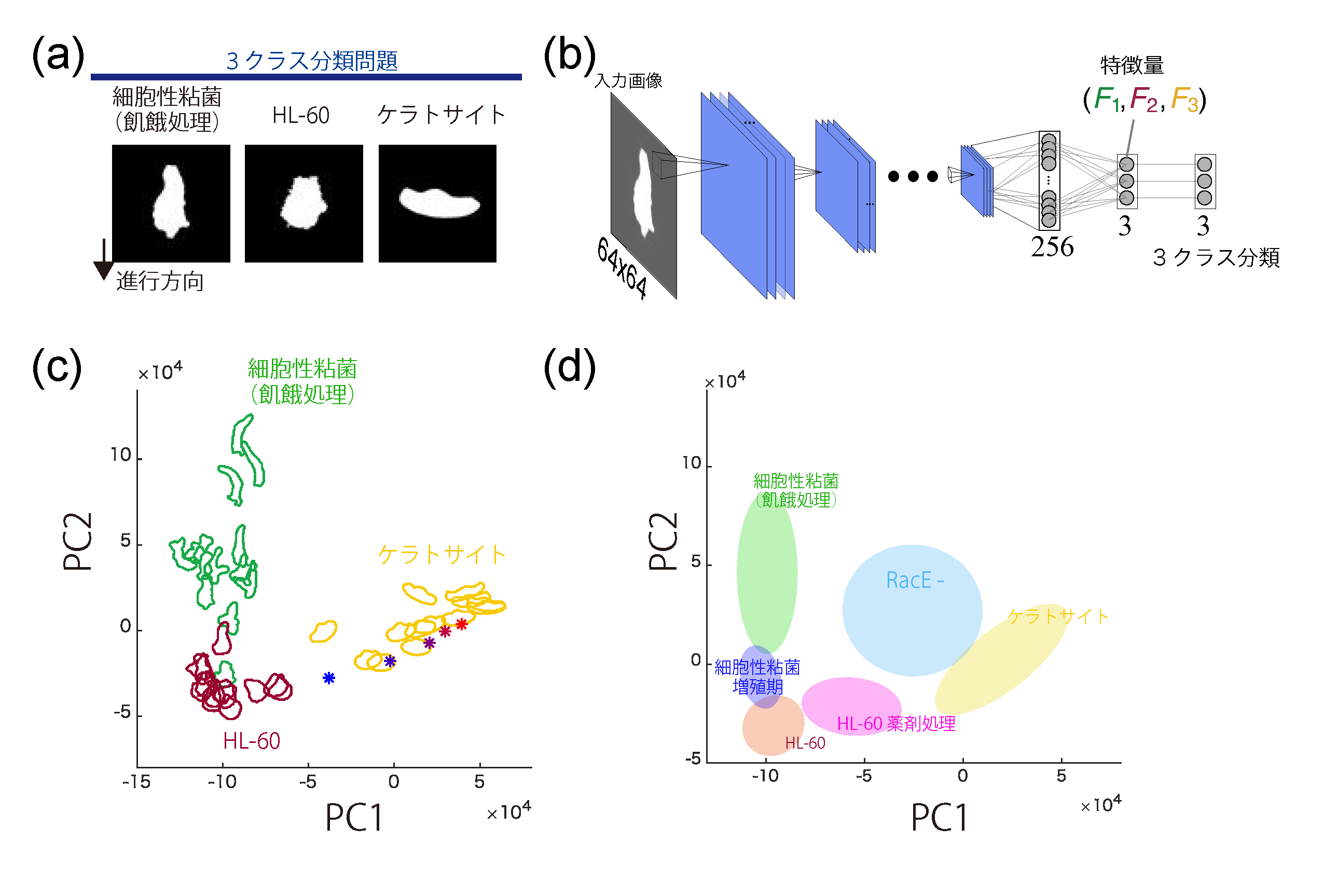
遊走性の細胞に典型的にみられる3種類の形の分類を、深層学習によっておこなうことで(パネルa,b)、形状についての特徴量が抽出した例(パネルc)。特徴量をトップダウン的に定めて解析する従来の手続きを踏まないため、体系的な解析が可能となる。また、解析する側が気づいていない特徴や、利便性の高い特徴量空間が得られる(パネルd)。 (Imoto et al (2021) PLoS Comput Biol 17, e1009237. 実験医学 より)

深層学習を用いた特徴抽出により、仮足形成と極性形成のダイナミクス双方の連動する反応拡散モデル(パネルa)による出力との比較検証が可能となる(パネルb,c)。体系的な解析を可能とすることで、模型のさらなる検証、改良につながります。 (Imoto et al (2021) PLoS Comput Biol 17, e1009237. 実験医学 より)
細胞遊走の走化性:方向決定に関わる情報処理特性
アメーバ細胞や免疫細胞などの這い回る細胞の移動方向の決定は、細胞外の場に含まれるどのような情報を細胞が知覚し、読み取り、行動を決定、未解決の課題を多く含んでいます。這い回る細胞の多くは誘引物質の濃度を細胞の前と後ろで比べ、濃度の高い側で、アクチンとよばれるタンパク質が樹状の線維を形成し、これによって膜を伸張し、濃度の低い側ではアクチンがミオシンとよばれるモータータンパク質によって架橋された収縮性をもった繊維を形成します。前で伸びて、後ろで縮む、この双方の過程が駆動源となって細胞は誘引因子への指向性の高い運動を示すと考えられています。これを走化性運動と呼びます。
仮足や細胞極性の形成をともなった走化性運動は、細胞性粘菌キイロタマホコリカビ Dictyostelium discoideum (以下、粘菌と略)と好中球で最も理解が進んでいます。粘菌の場合、細胞外にただよう葉酸がバクテリアの印として働きます。これに対する走化性運動によってバクテリアに接近し、これを捉えます。また飢餓になると、細胞が細胞外にサイクリックAMPを放出し、これに対して移動することで細胞が集合し、集合体を形成します。これらの因子に特異的に結合するGタンパク共役型受容体が存在し、その下流で細胞骨格系が調節されます。好中球も同様に、フォルミル基で修飾されたメチオニンを含むペプチドがバクテリアの存在を示す印として働きます。また炎症反応部位では、周辺組織から分泌されるケモカインに対する走化性を示します。こちらも粘菌同様、Gタンパク共役型受容体が存在し、その下流で細胞骨格系が調節されます。これらに共通するのは、細胞がこれらの「匂い」を頼りに、的確に目的の場所に移動できることが、これらの細胞の生存や、生体内機能にとって極めて重要である点です。
細胞性粘菌は微生物の一種ですが、単細胞で過ごす時期と細胞が集合して子実体と呼ばれる多細胞構造を形成する時期とを繰り返します。細胞が集合する際の誘引物質は、個々の細胞が分泌する環状核酸、サイクリックAMP(cAMP)です。粘菌細胞の集団では、このcAMPが波のように伝搬させ、その濃度変化を頼りに集合し、多細胞組織を構築します(図[1a])。しかし、cAMPの濃度が高い方に移動するというだけでは、「走化性パラドクス」(図[1b])と呼ばれる問題が生じます。つまり、cAMP波が細胞へ近づいてくるときはcAMP濃度がより高い方へ動けばよいのですが、cAMP波が細胞から離れていくときに、細胞がcAMP濃度の高い方へ動いてしまっては、細胞は結局元の位置に戻ってしまいます。細胞が波を積極的に検知しない時期を仮定するものや(不応期説)、細胞の動きが記憶されてそれが持続する(メモリー説)などが提唱されてきました。最近の私達の研究から、これらの性質がなくとも、誘引物質cAMPの濃度が経時的に増加する場合のみ、移動するための信号を細胞内に伝達することで、この性質が実現されることが明らかになっています。これには、微小流路内の層流形成によって空間的、時間的に誘引物質の濃度を高精度に制御する技術と、細胞の先端が形成される際の細胞内反応の定量的測定技術、という2つの技術の組み合わせが活躍しました。人工的に形成した動的勾配について、さまざまな時定数と、時間変化、空間変化の符合の組み合わせを検討し(図[2a])、細胞先端の形成を促す物質の一種であるRasタンパク質(低分子量GTP結合タンパク質)の活性化を、蛍光タンパク質を用いてレーザー共焦点顕微鏡により測定しました(図[2b])。これらのデータを、膜上のcAMP受容体下で生じる、Rasの局所的活性化と大域的抑制化で構成されるフィードフォワード型反応ネットワークモデルからの予想と比較すると、この反応系に強い抑制がかかっている場合に、cAMP濃度の上昇に反応してスイッチ的な応答が示されること、これによって、誘引物質濃度が時間とともに減少する場合は、誘引物質が存在するというシグナルが細胞内伝達経路の下流に伝わらないという性質(整流作用)が実現されることがわかりました。この「整流作用」によって、波の後ろ側で細胞が動かないのは、cAMPの濃度が減少しているからであるということが示唆されます。実際に、流路で与えた人工的な波以外にも様々な変動刺激にたいする応答が矛盾なく説明できることが示されています。

粘菌細胞の「走化性パラドクス」。a)細胞集団中で自己組織化される誘因物質cAMPのらせん波(緑)と波の中心へむかって移動する細胞(マゼンタ)。b) 「走化性パラドクス」の概念図。アメーバ細胞がcAMPの濃度の高い方へ移動するならば、波の空間勾配の方向は波の前面と背面で反転するため、進んで戻っての繰り返しで動けないため集合できません。時空間的に変化する情報を細胞がいかに統合して行動を決定するかを理解するために、理想的な例題です。(Nakajima et al (2014) Nat. Commun. 5, 5367 )
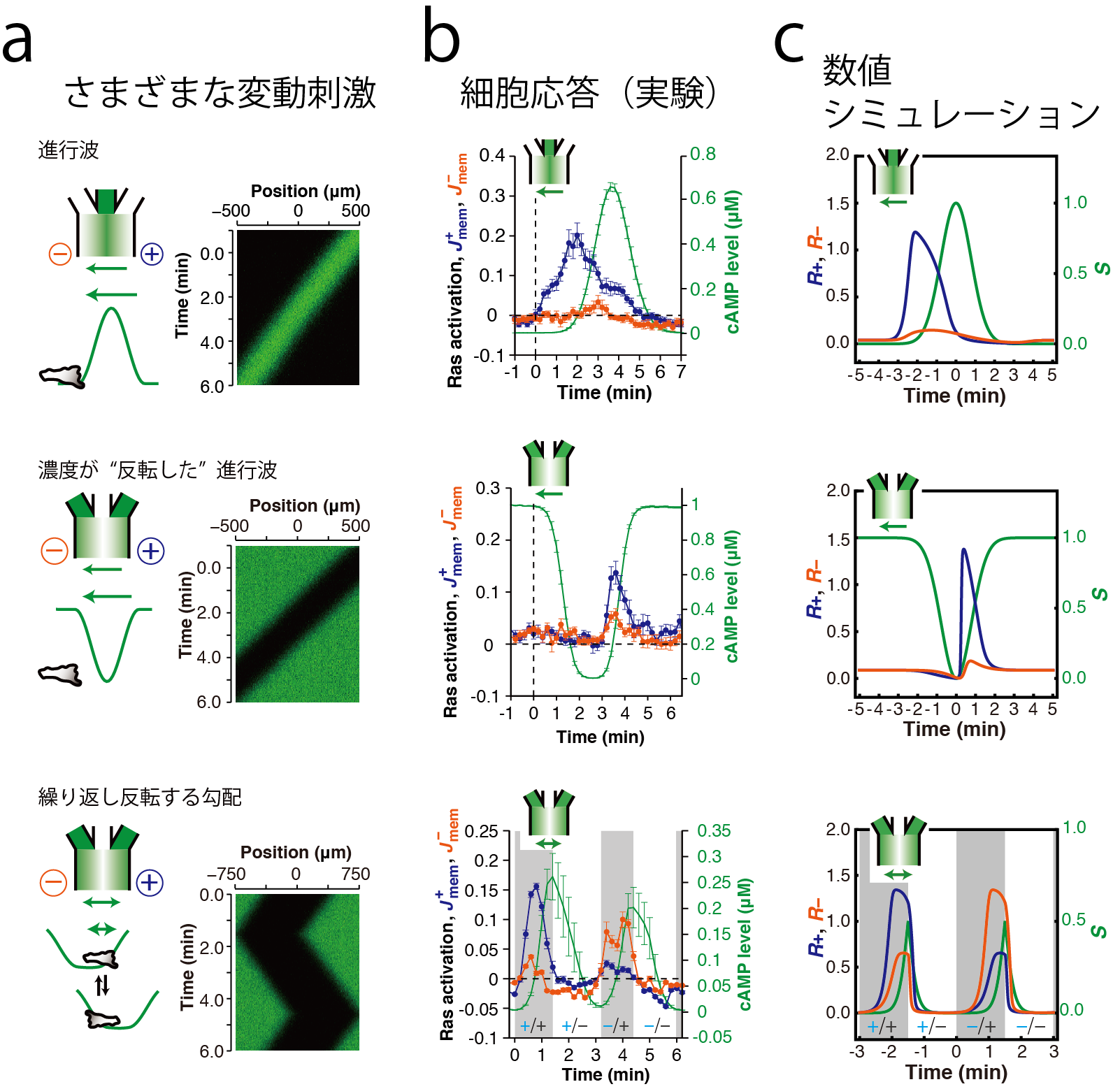
波の空間勾配と時間勾配の方向への依存性を様々な変動刺激で調べる。山型の進行波(上段)、谷型の進行波(中段)、周期的に反復させる谷型刺激。(Nakajima et al (2014) Nat. Commun. 5, 5367 )
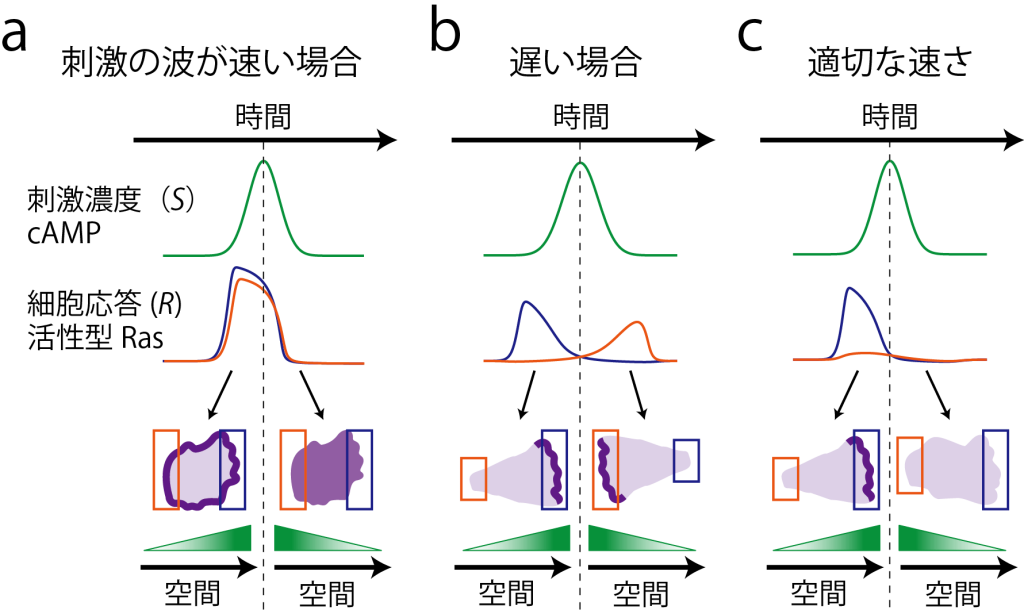
進行波刺激による前端形成の時間スケール依存性の概念図 。(a) 速い波では、刺激到達の時間差が短く、細胞全周にわたってアクチン重合が一過的に生じる。(b)遅い波では、系の応答が定常状態に達し、受容体占有率の空間的差異によって前端が決定する。(c)中間の速度では、アクチン重合の一過的応答が刺激が最初に到達した側で生じるが、細部内で大局的な抑制がかかり刺激に先回りすることで、逆側に前端ができなくなる。(Nakajima et al (2014) Nat. Commun. 5, 5367 )
アクチン波と興奮系ダイナミクス
アメーバ状の形態変化はヒト好中球やマクロファージなどの運動や食作用でもよく知られ、癌細胞が浸潤、転移する際にも同様の運動形態がみられます。こうした運動は全くのでたらめではなく、膜の伸縮、伸張と移動が柔軟なテンポとタイミングでおこなわれ、かつ細胞全体の変形としての調和がとれています。膜の裏打ちにおけるアクチンの重合は、ときに細胞全体を伝播する波(アクチン波)として時空間的に発展することが、粘菌や免疫細胞などの動物細胞で知られています。粘菌のアクチン波はRasの活性化をともない、PIP2からPIP3へのリン酸化を触媒するPI3キナーゼとよばれるタンパク質の活性化を促し、これが最終的に細胞骨格系アクチンを調節すると考えられています。波が細胞端に達した際に細胞膜がおされます。
興味深いことに、RasとPI3キナーゼの活性化は明示的な誘引シグナルが存在していない場合にもみられることから、細胞内のシグナルとなる分子の調節に関するフィードバックによる増幅によって自律的に生じると考えられます。アクチン波がいつどこで発生し、どの方向にむかって伝播し、いつどこで消滅しているかを手がかりとして、波のパターンと細胞形状の決まり方を調べました。アクチン重合の阻害剤や、PI3キナーゼの阻害剤で細胞を処理すると、波の発生は著しく低下し、そのパターンも単純化します(図1B)(Taniguchi et al (2013) PNAS 110, 5016-5021. )。波の空間的な配置を明らかにするために、波の時間的周期性に基づいて位相を抽出すると(図2A)、回転する波の中心に位相の特異点が存在していることがわかります。薬剤処理していない、自由にはいまわっている細胞についても同様の位相の特異点が出現しており、二つのペアとなっているものはその間で維持される波面が比較的平面的に膜を押し出していること、一つに隔離された特異点のまわりでは、回転するらせん波によって膜も回転しながら押し出していることが明らかになりました(図2B)(Taniguchi et al (2013) PNAS 110, 5016-5021. )。膜上では、既存の波と新規に発火する波が常に競合しており、波と波が衝突した際に位相がどの程度シフトするかを解析したところ、新規の波が既存の波の裏側で発火したときに、位相が不連続的にリセットされ特異点が出現することがわかりました。位相の特異点は、不整脈時の心筋の収縮場や、粘菌の集合場におけるcAMP波にも共通してみられる動的構造です。
特異点は空間的にドリフトして細胞端まで到達すると消滅すること、また伝播した波が細胞端に到達すると消える場合と反射する場合があることも明らかになりました。位相の特異点がない場合には、並進波や反射波が支配的となり、一度特異点が出現すると、興奮状態が自己充足的に維持され回転波を生み出します。一見複雑に見える波でも、並進波、反射波、回転波の3つの基本要素から構成され(図1B)、どの成分が多いかは位相の特異点の有無、場所と数によります(Taniguchi et al (2013) PNAS 110, 5016-5021. )。さらに、数理モデル(図3A)による解析から、正のフィードバックによりPIP3の微小な濃度ゆらぎが増幅されPI3キナーゼが活性化されると、さらにPIP3が上昇し、これが膜上を拡散して周りにつたわり、さらにPI3キナーゼが活性化されるという連鎖が引き起こされることがわかります。こうして発生した波は細胞端にむけて伝播し、途中で他の波と衝突すれば、その位相の関係によって消滅する、あるいは特異点を形成します。これらのダイナミクスの組み合わせによって波のパターンが複雑化し、時間的に空間的にリズムをもっている形状変化を引き起こすことが予想されました(図3B)。ゆらぎによって、ランダムな場所で波が発生する一方で、波それ自体の発展規則は決定論的です。規則性とランダム性の両方がせめぎあうことで、複雑なアメーバ形状の自発的な変化が生み出されています。これらの解析結果は、アメーバ細胞を駆動するリン脂質/アクチンの波が興奮系(注4)特有の現象として理解できることを示しています。
アクチン波は平面上の基質上ではランダムな位置で出現しているように見えます。ところが、基質にマイクロメートルスケールの凹凸構造があると、凸構造の直上の細胞膜で発生することがわかりました(Honda et al (2021) PNAS 118 (50) e2110281118 )。この性質は、アクチン重合を薬剤で抑えた状態であっても、またPI3キナーゼが欠損した細胞であっても、局所的なRas-GTPの分布として確認されます。

細胞端に到達したアクチンが細胞の大規模な変形を促す。A) ガラス基質に接着した細胞の細胞質側にみられる自己組織化的な波(アクチンとPIP3)。Fアクチンに選択的に結合するLimEタンパクのN末端に緑色蛍光タンパクを融合したもの(LimE-GFP)と、PIP3に結合するCRACタンパク質のPHドメインに赤色蛍光タンパクを融合したもの(PH-RFP)を発現することによる可視化。B)薬剤処理した細胞内に見られる波の基本パターン。発火頻度が低下することで、波と波の競合がなくなり、単一の波面が観察される。上:一過性の並進波、中:らせん波、下:反射波。PH-RFPと同時に、PIP3からPIP2への脱リン酸化を触媒するPTENにGFPを融合させたタンパクによる可視化。(Taniguchi et al (2013) PNAS 110, 5016-5021. )

細胞膜のPIP3/Fアクチン波の周期性をウェーブレット変換により抽出する。(A)これによって位相が空間的にどのように配置しているかがわかる。特に位相の特異点は、すべての位相が一箇所で交わる極(らせん波の中心)であり、波が自己充足的に維持される。(B)位相の特異点の生成と消滅によって、波面が細胞端にどのように到達するかが決まる。通常、特異点は対で生成するが、片方が消滅すると、片椀型のらせん波として回転をともなって伝播し、これによって、細胞膜も回転するように伸長する。

(A) 細胞膜のPIP3の生成反応と、膜の伸長をフェーズフィールド法によって結合させた反応拡散モデル。 (B)数値計算から、波のダイナミクスと変形の特徴をとらえることができる。
細胞の協調的振る舞いとその頑健性
細胞性粘菌では、数十万個の細胞が走化性誘因物質であるサイクリックAMP(cAMP)を数分間のリズムで放出し、それによって形成される進行波に向かって集合し、多細胞体制(子実体)を構築します。cAMPの振動と波は細胞の運動方向を決めるため細胞集合にとって必須であるだけでなく、このリズム信号を受けることによって細胞は餌を食べることを停止します。アメーバは独立して餌を探し続けるか、もしくはお互いに協力し合って子実体を形成するか。生死をかけた選択の、集団的な意思決定とも言える現象です。このアメーバの集団現象がいかに出現して、指揮されているか、これまで二通りの可能性が考えられました。最初の可能性は、ある固有な細胞が指揮者としての役割をもっていて、誘因物質の放出を繰り返し、周りの細胞がそれに応答するというものです。二つ目の可能性は、どの細胞も特性は同じで区別がなく、誘因物質を放出するかどうかは、細胞間で何らかの信号のやりとりがあって、それによる評決で全会一致により出現する協同的な振る舞いであるというものです。
蛍光タンパクを利用したcAMP測定用のプローブを粘菌で発現させ、細胞性粘菌のcAMP 振動を、生きた状態で可視化しました(図パネルa)(Gregor et al (2010) Science 328, 1021-1025.)。この観察法を用いて、隔離した細胞の振る舞いを特徴づけました。外部からのcAMP刺激が除かれている場合、細胞は非常に稀に確率的な発火を示すだけで、自律的には振動できないこと、1nM濃度の細胞外cAMPで決定論的な適応的応答が示されます。こうした観察から、予めリーダー的な役割を担っている固有の細胞は存在しないことが確認されました。また、細胞を入れたチャンバー内に流す緩衝液の速度と細胞密度に依存して、集団的な発火の頻度がコントロールできることを実験と理論の両面から実証しました (Gregor et al (2010) Science 328, 1021-1025.)。これらを総合した理論モデルに基づき、振動が生じる際の詳細を計算すると、個々の細胞のランダムな発火が連鎖的に蓄積されていった結果、集団の発火が生じることがわかります(図パネルc)(Gregor et al (2010) Science 328, 1021-1025.)。粘菌のcAMP振動は、1細胞の閾値的な振る舞いに単純に還元されない協同的な現象で、細胞同士の相互作用の中から全会一致でcAMPリズムが出現する動的な構造が、指揮者として機能することを意味しています。また、発火頻度が細胞密度に依存して増加することから、cAMP振動の周波数には細胞集団についての情報がコードされています。
この細胞性粘菌のcAMP振動は、細胞密度が異なっていても、また途中で細胞を回収して周りの因子を洗い流したとしても、比較的再現性よく出現することが知られています。私達の研究から、2つの興味深い性質がこのことに関わっていると考えています。上記の実験から、細胞集団のcAMP振動は灌流による希釈が重要なパラメータになっていることがわかります。これは本来は、細胞外に分泌される分解酵素ホスホジエステラーゼ(PDE)によっています。PDEをコードする遺伝子pdsAのmRNA発現を単一細胞で可視化して解析すると、1nM cAMPで発現が誘導され、それ以下でもそれ以上の濃度でも発現が抑えられていることがわかりました(Masaki, Fujimoto et al (2013) Biophys J. 104(5), 1191-1202.)。
細胞外cAMPの蓄積が十分でない場合は、それを促し、応答するに足りる濃度のcAMPが蓄積すると分解酵素が産生されることで、細胞外のcAMP濃度は一定の濃度レンジを保ちやすくなります。このことで、振動を継続する時間が延長し、細胞の集合にとって都合がよいと考えられます。もうひとつは、細胞外cAMPの刺激によって引き起こされるcAMP産生の大きさは、細胞外cAMPの絶対濃度ではなく、その時間的変化比(倍変化)によって決まるという性質です。この性質によって、細胞は細胞外cAMPのベース濃度がずれていても、同様の振動現象を引き起こすことができます。ある理想化された概念モデルでは、倍変化応答が出力され、これが入力として働いて生じる振動は、細胞密度に依存しないというスケール不変性が示されます(Kamino et al (2017)PNAS 114 (21) E4149-E4157)。
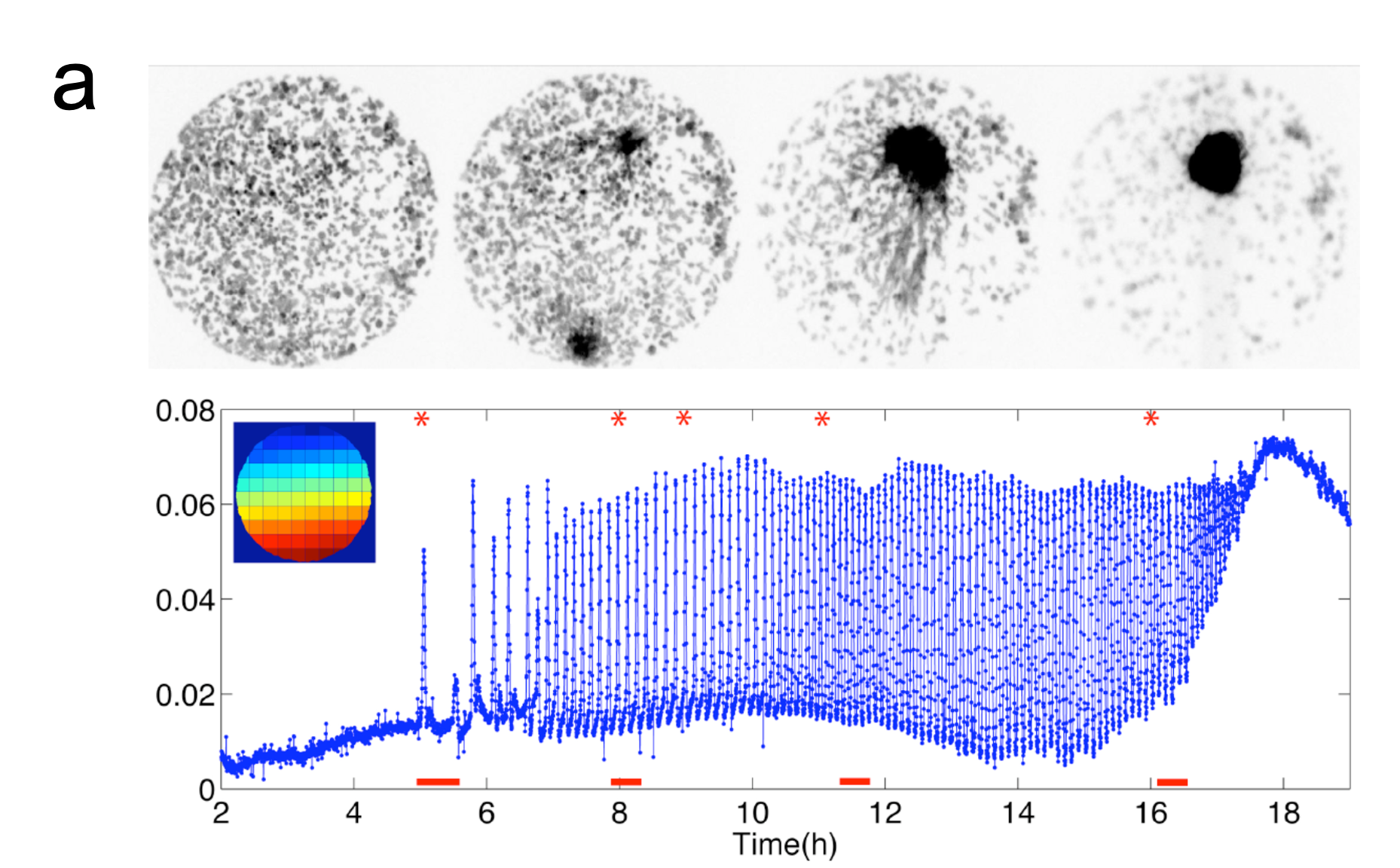
約200個の粘菌アメーバが集合する際のcAMP振動を観察した様子。はじめ20〜30分おきにランダムな場所から出現していた波は、次第に頻度を上げてゆき、最終的に6分周期で波が開始される場所が決定し、細胞は集合する。(Gregor et al (2010) Science 328, 1021-1025.)
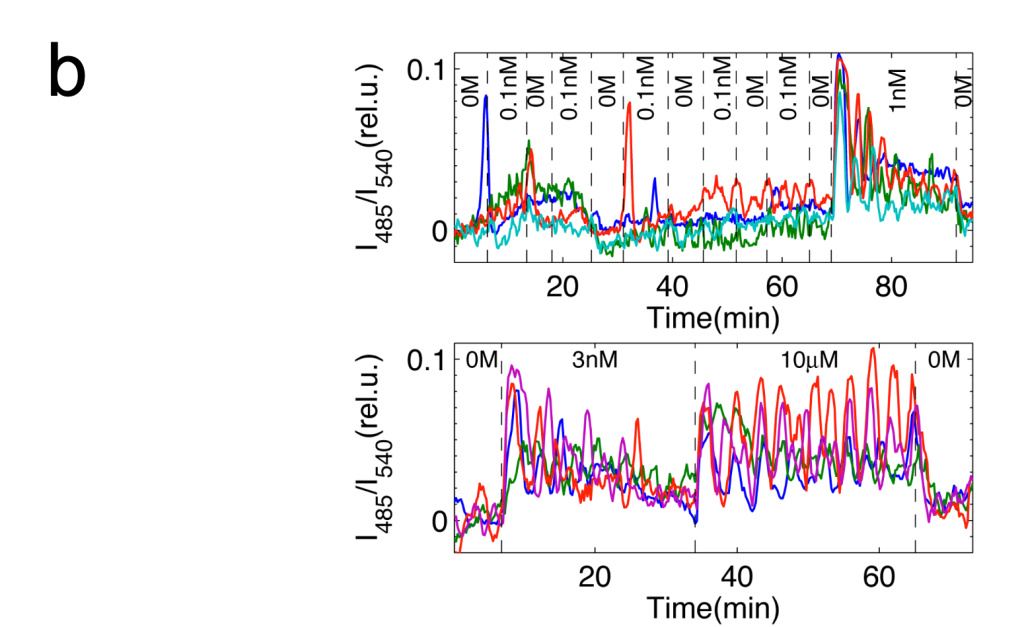
灌流によるステップ入力に対する単一細胞の応答。点線で囲まれた時間窓に表記の濃度のcAMPが投与されている。(Gregor et al (2010) Science 328, 1021-1025.)
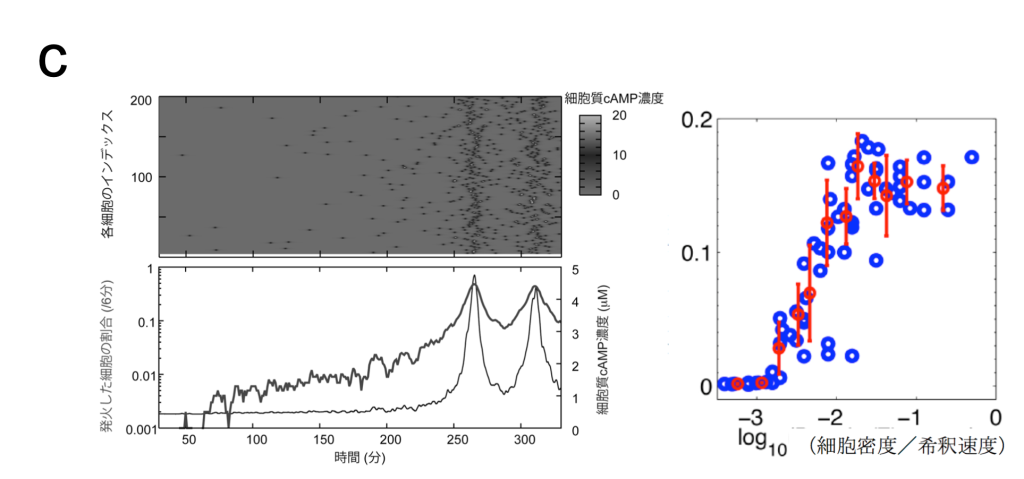
(左)確率的なcAMPの放出が蓄積し、集団でそろった発火が生じることを示す計算シミュレーション結果。(右)細胞の密度が高まるなど細胞外のcAMP濃度を増加するような環境下で、集団の発火頻度は上がる。最終的に6分周期の振動を許すような状況になった地点が、信号の中心となることがわかる。(Gregor et al (2010) Science 328, 1021-1025.)
細胞集団運動と細胞性粘菌の形態形成
組織中の細胞運動は、リンパ球の多くが示す単独性のものと、上皮細胞が示す集団性のもの、さらにこれらの中間的性質をもったものがあります。これらをひっくるめて、その指向性の運動は集団的遊走(collective migration)と呼ばれます。動物発生では、ショウジョウバエのボーダー細胞、ゼブラフィッシュの側線、アフリカツメガエルの神経堤細胞などがよく知られています。また、癌細胞の浸潤はよくわかっていないことが多いですが、癌細胞が列となって移動しているとみられる事例も知られています。これらがもつ機能はそれぞれ固有であるものの、いくつかの共通性が認められます。一つは細胞それぞれが自律的に動く駆動性を維持している点。上皮細胞の場合、強い細胞間接着によって自らが動く面は少ないと考えがちですが、隠れた仮足「cryptic lamellipodia」を忍ばせていることが知られています。2番目は、細胞の移動方向を揃えるための仕組みを有している点です。これは誘引分子に対する走化性と、細胞間接触による極性形成の主にに2つによっていると考えれます。ショウジョウバエのボーダー細胞ではEGF受容体に対するリガンドが誘引分子として働きます。側線や神経堤細胞ではケモカインが誘引因子として知られています。また、接触あるいは接着による運動性の調節は、インテグリンやカドヘリン、さらにその調節因子として働くビンキュリン、タリン等のタンパク質が集積した接着斑と呼ばれる構造によって、アクチンとのクラッチを担うと考えられています。3番目は、集団内で運動等の分業が見られる点です。特に、先頭の細胞や細胞集団は舵取り役、先鋒隊として働きます。
興味深いことに、これらの性質は動物以外でも、アメーバ界の細胞性粘菌にも見られます。細胞性粘菌キイロタマホコリカビは、アメーバ界で多細胞体制を進化させた、謎に満ちた生き物として古くから知られています。飢餓状態に陥ると、子実体と呼ばれる多細胞組織を、細胞運動による集合と再配置によって形成します(図1A,B)。子実体は主に柄細胞と胞子細胞の2種類の細胞型からなっていますが、これらは集合塊内で当初ランダムな位置で出現し、将来柄となる細胞(予定柄細胞)がやがて頂端へと配置されます(図1C)。このような現象は、細胞型に依存した細胞選別と呼ばれ、動物発生にも共通して見られる現象ですが、細胞の移動方向や配置を決定する基本的ルールは、系が複雑なため、解読することがほとんど困難です。細胞性粘菌の運動は、細胞自身が分泌するサイクリックAMP (cAMP)が誘引分子として働き、これに向かう走化性運動がよくわかってきています。一方で、走化性とは別に、細胞の運動方向を決定する仕組みとして、1962年に当時英国ケンブリッジ大学動物学講座のShaffer教授が、粘菌細胞間は接触することで後ろの細胞が前の細胞を追いかけているとする、「接触追従」を素朴な顕微鏡観察に基づいて提唱しました。しかし、走化性の実態すら不明であった当時の分子生物学的知見や細胞操作の技術では、運動方向を決定する諸要因を切り分けて解析することができず、長きにわたってこのアイデアが日の目をみることはありませんでした。その後の研究でも、隣接する細胞間のヘテロフィリックな接着を担う細胞間接着分子TgrB1とTgrC1が細胞選別へ関与していることが遺伝学的に示唆されていました。TgrB1, TgrC1はIg-ドメインをもった細胞膜上のタンパク質ですが、これが具体的に選別運動にどのような働きをもっているか分かっていませんでした。
私達の研究では、微小流路を用いた詳細な測定をおこない、走化性とは別に、細胞間の接触によって細胞の運動方向が決まる性質、接触追従を明らかにしました (Fujimori et al (2019) PNAS 116, 4291-4296 )。この追従運動は、連結した細胞のうち、前方細胞のTgrC1分子と後方細胞のTgrB1分子に依存していました(図2A)。接触に追従運動する細胞はそれに応じて強い前後の細胞極性(注3)を示し、一方で、細胞外cAMP濃度勾配の摂動に対して、その運動方向を追従させにくい、つまり走化性の応答性が低いことが分かりました。細胞間接着領域では、単独で運動する細胞には見られない持続的なSCAR複合体の局在とF-アクチンの強い形成が観察され、これらが追従運動時の細胞先端の顕著な伸張と細胞極性をもたらしていると考えられます(図2B)。同様のSCAR複合体の局在と強いF-アクチンの形成は、精製した細胞間接着分子TgrC1と糖結合タンパク質の一種である小麦胚芽凝集素(WGA: 細胞との接着を補強する)をコートしたシリカビーズと細胞との接着領域にも生じました。このことは追従運動が、細胞外に分泌されたcAMPとは独立した、Tgrを主とする細胞間接着機構に強く依存した現象であることを示しています(図2C)(Fujimori et al (2019) PNAS 116, 4291-4296 )。精製したTgrB1またはcAMP分解酵素を細胞集合塊に投与し、接着シグナルまたは走化性シグナルが阻害された条件下では、いずれの場合も予定柄細胞が頂端へ選別されなくなることから、cAMPへの走化性とTgrを介した追従運動の双方が、細胞選別時の細胞移動方向の決定に深く関与していると考えられました。そこで、TgrC1をコートしたビーズへの接着によって形成された細胞極性とは直交する方向にcAMPの濃度勾配を提示したところ、予定柄細胞はcAMPに向かう運動を示したのに対し、予定胞子細胞はビーズに接着し極性を保ったままでした(図3A)。以上の結果は、走化性誘引分子と細胞間接着分子による移動方向の決定は、細胞型によって排他的に選択されており、これによって細胞型に依存した組織内の配置変え、細胞選別が生じていることを強く示唆しています(図3B)(Fujimori et al (2019) PNAS 116, 4291-4296 )。
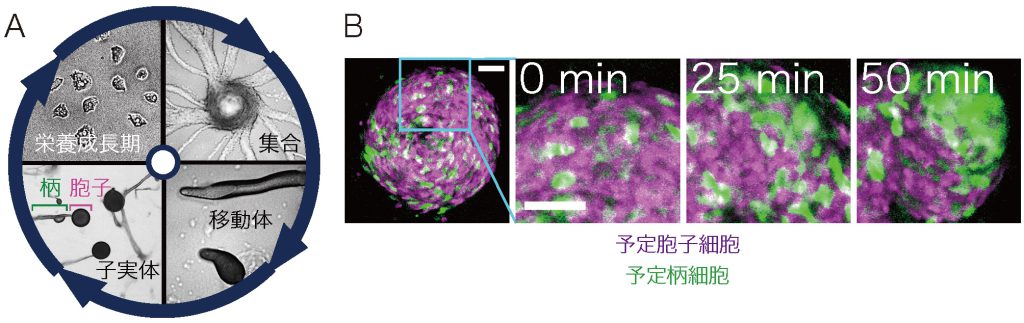
(A) 細胞性粘菌の生活環。土壌中では細菌を捕食し増殖する(左上)。飢餓状態に陥ると集合し(右上)、移動体となって地表へ這い出る(右下)。最終的に柄と胞子からなる子実体を形成する(左下)。胞子は栄養環境が好転すると再び単細胞アメーバとして増殖を開始する。(B) 細胞性粘菌の子実体(実体顕微鏡写真) (C) 集合後の細胞塊中で、将来柄になる予定柄細胞(白)と将来胞子になる予定胞子細胞(灰色)がランダムな配置で出現する。予定柄細胞は徐々に集合塊の頂端へと集まり各細胞タイプは分離する。これを細胞選別と呼び、以降の集団運動と子実体形成に必須のプロセスである。(Fujimori et al (2019) PNAS 116, 4291-4296 )
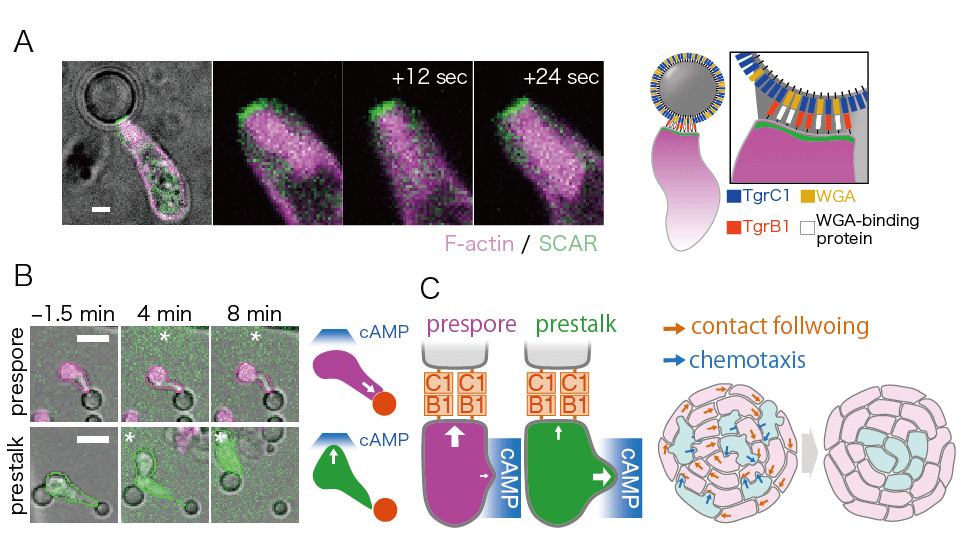
予定柄細胞と予定胞子細胞のシグナルに対する選択性 (A) TgrC1とWGAをコートしたビーズにより接着シグナルを受容している細胞に対し、ガラスニードルでcAMP濃度勾配を提示した。予定胞子細胞は接着シグナルを優先しやすいのに対し(上段)、予定柄細胞は走化性シグナルに応答しやすかった(下段)。 (B) 予定胞子細胞は接着シグナルを優先することで集団的に運動する一方、予定柄細胞は走化性シグナルに応答しやすいことで予定胞子細胞から離れて頂端に集まることで細胞選別が起こることが説明できる。(Fujimori et al (2019) PNAS 116, 4291-4296 )